A valenciakötés (VB) elmélet egy kémiai kötési elmélet, amely magyarázza a vegyi anyagot kötődés kettő között atomok. A molekuláris orbitális (MO) elmélethez hasonlóan a kvantummechanika elveivel magyarázza a kötést. A vegyértékkötési elmélet szerint a kötést a félig töltött atom átfedése okozza pályák. A két atom ossza meg egymás páratlan elektronát, hogy egy kitöltött pályát képezzen a hibrid orbitális és összekötjük. Sigma és pi kötvények a valenciakötés elmélet részei.
Kulcsfontosságú elvihetőség: Valence Bond (VB) elmélet
- A valenciakötés-elmélet vagy a VB-elmélet kvantummechanikán alapuló elmélet, amely elmagyarázza a kémiai kötés működését.
- A valenciakötési elméletben az egyes atomok atomi pályáit kémiai kötésekké kombinálják.
- A kémiai kötés másik fő elmélete a molekuláris orbitális elmélet vagy az MO-elmélet.
- A valenciakötési elmélet magyarázatot ad arra, hogy hogyan alakulnak ki kovalens kémiai kötések több molekula között.
Elmélet
A valenciakötési elmélet előrejelzi az atomok közötti kovalens kötés kialakulását, amikor félig töltött valencia atompályáik vannak, amelyek mindegyike egyetlen páratlan elektronot tartalmaz. Ezek az atomi pályák átfedésben vannak, tehát az elektronoknak a legnagyobb valószínűsége, hogy a kötés régiójában vannak. Mindkét atom ezután megosztja az egyetlen páratlan elektronokat, hogy gyengén kapcsolt orbitálokat képezzen.
A két atompályának nem kell azonosnak lennie egymással. Például a szigma és a pi kötés átfedésben lehet. A Sigma-kötések akkor alakulnak ki, amikor a két megosztott elektronnak olyan orbitái vannak, amelyek átfedik egymást. Ezzel szemben a pi kötések akkor alakulnak ki, amikor az orbitálok átfedésben vannak, de párhuzamosak egymással.
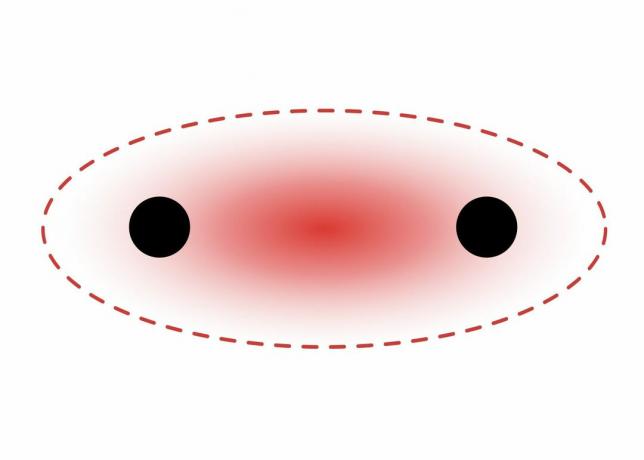
A Sigma-kötés két s-pálya elektronja között alakul ki, mivel az orbitális alak gömb alakú. Az egyes kötések egy szigmakötést tartalmaznak. A kettős kötések tartalmaznak egy szigmakötést és egy pi kötést. A hármas kötések tartalmaznak egy szigmakötést és két pi kötést. Amikor az atomok között kémiai kötések alakulnak ki, akkor az atomi pályák szigma és pi kötések hibridjei lehetnek.
Az elmélet segít megmagyarázni a kötés kialakulását azokban az esetekben, amikor a Lewis felépítése nem tudja leírni a valódi viselkedést. Ebben az esetben több vegyértékkötés-struktúra alkalmazható egyetlen Lewis-sztriktúra leírására.
Történelem
A valenciakötés elmélete a Lewis-struktúrákból merül fel. G. N. Lewis ezeket a struktúrákat 1916-ban javasolta, azon az elképzelésen alapulva, hogy két megosztott kötési elektron kémiai kötéseket képez. A kvantummechanikát alkalmazták a kötődési tulajdonságok leírására az 1927-es Heitler-London elméletben. Ez az elmélet a H2 molekula hidrogénatomjai közötti kémiai kötés kialakulását írta le Schrödinger hullám-egyenletével a két hidrogénatom hullámfunkcióinak összevonására. 1928-ban Linus Pauling kombinálta Lewis párkötési ötletét a Heitler-London elmélettel, hogy javaslatot tegyen a vegyértékkötési elméletre. A valencia kötés elméletet fejlesztették ki a rezonancia és az orbitális hibridizáció leírására. 1931-ben Pauling „A kémiai kötés természetéről” című könyvet tett közzé a vegyértékkötések elméletéről. Az első számítógépes programok a molekuláris orbitális elmélet kémiai kötésének leírására, de az 1980-as évek óta a valenciakötés elmélet alapelveivé vált programozható. Manapság ezeknek az elméleteknek a modern verziói versenyeznek egymással a valós viselkedés pontos leírása szempontjából.
felhasználások
A valenciakötvény elmélet gyakran megmagyarázza, hogyan kovalens kötések forma. Az kétatomos fluor molekula, F2, egy példa. A fluoratomok egyetlen kovalens kötést képeznek egymással. Az F-F kötés átfedés eredménye pZ pályák, amelyek mindegyike egyetlen páratlan elektronot tartalmaz. Hasonló helyzet fordul elő hidrogénnél, H2, de a kötési hossz és az erő eltér H között2 és F2 molekulákat. Kovalens kötést képez a hidrogén és a fluortartalom között hidrogén-fluorid savban (HF). Ez a kötés az 1 hidrogén átfedéséből képződiks orbital és a fluor 2pZ orbitális, amelyek mindegyikének páratlan elektronja van. A HF-ben mind a hidrogénatom, mind a fluoratom megosztja ezeket az elektronokat kovalens kötésben.
források
- Cooper, David L.; Gerratt, Joseph; Raimondi, Mario (1986). "A benzolmolekula elektronikus szerkezete." Természet. 323 (6090): 699. doi:10.1038 / 323699a0
- Messmer, Richard P.; Schultz, Peter Peter (1987). "A benzolmolekula elektronikus szerkezete." Természet. 329 (6139): 492. doi:10.1038 / 329492a0
- Murrell, J.N.; Kettle, S.F.A.; Tedder, J. M. (1985). A kémiai kötvény (2. kiadás). John Wiley & Sons. ISBN 0-471-90759-6.
- Pauling, Linus (1987). "A benzolmolekula elektronikus szerkezete." Természet. 325 (6103): 396. doi:10.1038 / 325396d0
- Shaik, Sason S.; Phillipe C. Hiberty (2008). Vegyész útmutató a Valence Bond Theory-hoz. New Jersey: Wiley-köztudomány. ISBN 978-0-470-03735-5.